Dolor Torácico durante la diálisis
El dolor torácico en pacientes en hemodiálisis representa un desafío clínico significativo debido a su potencial gravedad. Aunque en algunos casos puede tener etiología benigna, también puede ser la primera manifestación de eventos cardiovasculares mayores. Su abordaje requiere una evaluación rápida, estructurada y multidisciplinaria.
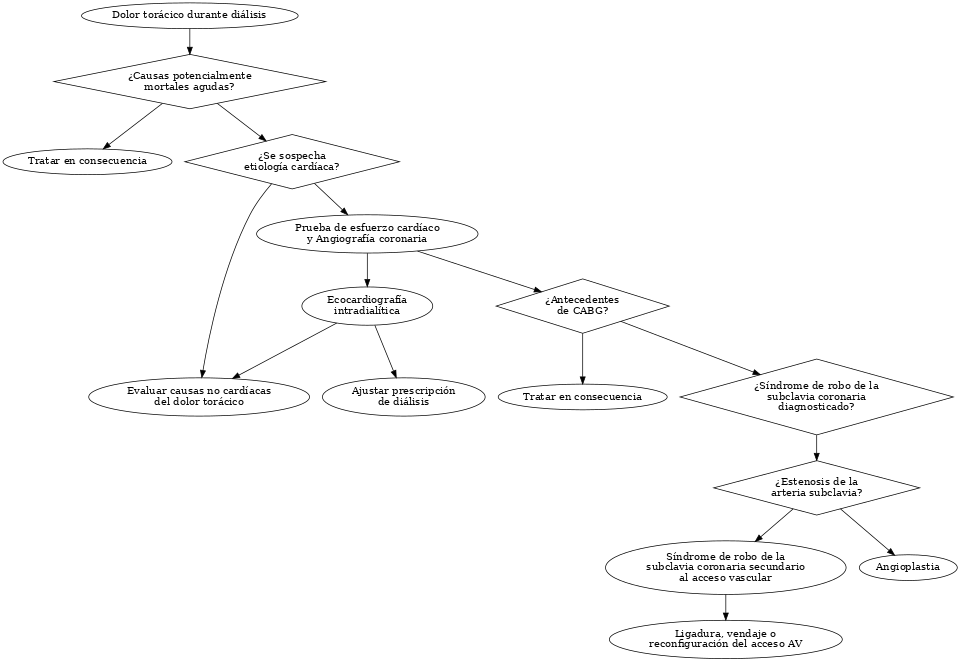
1. Evaluación Inicial: Ante la presencia de dolor torácico, se deben descartar causas potencialmente letales como el síndrome coronario agudo (SCA), arritmias, disección aórtica, embolia pulmonar o embolia gaseosa. Es prioritario detener la diálisis, colocar al paciente en decúbito, revisar la línea venosa (en busca de espumado o hemólisis), y si se sospecha complicación grave, activar servicios de emergencia. Estudios reportan que el dolor torácico leve ocurre en 1–4% de las sesiones de diálisis, pero la alta incidencia de muerte súbita cardíaca (principal causa de muerte en estos pacientes) obliga a actuar con prontitud.
2. Medidas Inmediatas: Se recomienda monitorización cardíaca continua, oxígeno suplementario, toma de signos vitales, electrocardiograma de 12 derivaciones y obtención de marcadores cardiacos. Si hay sospecha de SCA, administrar aspirina (325 mg) y nitroglicerina sublingual si no hay hipotensión. En pacientes inestables, debe activarse de inmediato un traslado a urgencias con desfibrilador disponible.
3. Historia Clínica y Exploración Física: Se debe obtener información detallada sobre la naturaleza del dolor (opresivo, urente, irradiado, asociado a disnea o diaforesis). La isquemia miocárdica puede presentarse de forma atípica: en un estudio, solo el 44% de pacientes en diálisis con infarto agudo de miocardio presentaron dolor torácico, comparado con el 68.4% de los no dializados. La exploración física puede revelar signos como el “signo de Levine” (puño cerrado sobre el tórax) o síntomas como disnea o palpitaciones. El dolor desgarrante con irradiación interescapular sugiere disección aórtica. La pericarditis urémica, embolia pulmonar o neumonía también deben considerarse.
4. Evaluación del Acceso Vascular: El examen del acceso arteriovenoso (AV) puede revelar pistas clave. Una fístula hiperfuncionante puede generar falla cardíaca de gasto elevado. También debe considerarse el síndrome de robo coronario-subclavio en pacientes con bypass de arteria mamaria interna (IMA) ipsilateral a la fístula AV, ya que la fístula puede desviar flujo coronario. Gaudino et al. demostraron reducción significativa del flujo en el injerto IMA durante la diálisis en estos pacientes, junto con hipocinesia ventricular izquierda anterior. En estudios por Doppler, se ha documentado reducción en la velocidad sistólica y diastólica, además de cambios hipocinéticos del ventrículo izquierdo.
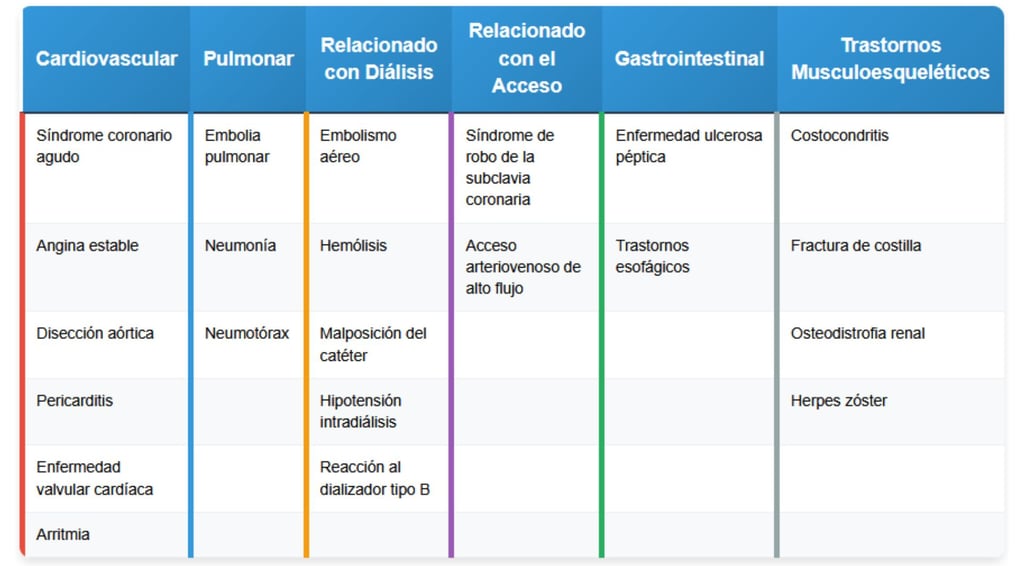
5. Diagnóstico Diferencial:
Isquemia miocárdica / Infarto agudo
Disección aórtica
Pericarditis urémica
Hipotensión intradiálisis con "stunning" miocárdico
Embolia de aire o pulmonar
Hemólisis
Reflujo gastroesofágico
Dolor osteomuscular
6. Estudios Complementarios: Laboratorio: troponinas, hemograma, electrolitos, BUN, creatinina. Imagen: radiografía de tórax, ecocardiograma transtorácico, estudios de perfusión miocárdica, angiografía coronaria. La ecocardiografía intradiálisis ha demostrado identificar alteraciones segmentarias de la contractilidad (RWMA), lo que sugiere isquemia silenciosa inducida por diálisis (McIntyre et al.). El estudio de Dasselaar et al. también mostró reducción temprana del flujo miocárdico durante la sesión de diálisis.
7. Manejo de Enfermedad Arterial Coronaria (EAC): El tratamiento incluye fármacos (nitratos, betabloqueadores, calcioantagonistas, estatinas, antiplaquetarios) y revascularización (angioplastía o CABG). El uso de stents farmacoactivos (DES) mejora la permeabilidad, aunque implica terapia antiplaquetaria dual prolongada. Un metaanálisis de 17 estudios no aleatorizados mostró menor mortalidad total y cardiovascular con DES comparado con stents convencionales (BMS), aunque con mayor riesgo de sangrado en pacientes en diálisis (referencia [32]). El estudio Veterans Affairs demostró aumento del riesgo hemorrágico con terapia antiplaquetaria dual.
8. Fístula AV de Alto Flujo: Puede generar sobrecarga cardíaca. Estudios ecocardiográficos han mostrado que una semana tras la creación de una fístula AV se incrementa el volumen telediastólico y el gasto cardíaco en un 15% (referencia [15]). Si el flujo del acceso (Qa) supera los 2000 mL/min sin aumento proporcional del gasto cardíaco, puede desencadenarse insuficiencia cardíaca de alto gasto. El estudio de Korsheed et al. mostró menor prevalencia de hipertrofia ventricular izquierda en pacientes con AVF de flujo moderado comparado con aquellos con flujos altos (>2000 mL/min).
9. Síndrome de Robo Coronario Subclavio: El flujo coronario puede invertirse si el acceso AV drena flujo desde un injerto de IMA ipsilateral. Angiográficamente se ha demostrado flujo retrógrado en diástole en el injerto IMA. La oclusión temporal del acceso AV puede restaurar el flujo anterógrado, confirmando el diagnóstico. Este síndrome debe distinguirse de una estenosis subclavia primaria, lo cual requiere imágenes vasculares específicas (angiotomografía o Doppler). El uso de angiografía con medición hemodinámica permite confirmar el diagnóstico con precisión.
10. Consideraciones Terapéuticas Adicionales:
Ajustar la técnica de diálisis: disminuir la ultrafiltración, reducir temperatura del dializado, aumentar frecuencia o cambiar a diálisis peritoneal.
Individualizar metas de presión arterial: presión muy baja aumenta riesgo de mortalidad y falla del acceso.
Controlar anemia (Hb 11–12 g/dL), hiperparatiroidismo y sobrecarga de volumen, todos ellos asociados a disfunción cardiovascular. La corrección excesiva de hemoglobina se ha asociado con mayor mortalidad (estudios 4D y AURORA).
Conclusión: El dolor torácico en pacientes en hemodiálisis representa una urgencia diagnóstica y terapéutica. Requiere descartar causas críticas, iniciar estabilización inmediata y realizar un abordaje integral con base en evidencia científica. La patología cardiovascular sigue siendo la causa principal de muerte en esta población (42% según datos 2007–2009), por lo que es fundamental adoptar estrategias de prevención, diagnóstico precoz y tratamiento individualizado. La identificación y corrección de factores modificables como el flujo excesivo de accesos AV, manejo de la hipotensión intradiálisis y ajustes individualizados del tratamiento son esenciales para mejorar el pronóstico.